計画研究佐藤班(A01)の安藤敏夫先生(金沢大学数物科学系)のミオシンVのAFM解析に関する論文が、Nature電子版に引き続き、朝日新聞(10/11付)、毎日新聞(10/11付)、北國新聞(10/11付)に掲載されました。また、研究内容の紹介をするための記事を寄稿して頂きましたので、是非ご覧下さい。
タンパク質の構造動態を直接高解像撮影することに成功
(モータタンパク質が動く仕組みを解明)
金沢大学 理工研究域数物科学系の安藤敏夫教授と古寺哲幸助教らの研究グループは、世界最高性能の高速原子間力顕微鏡を開発し(図1)、アクチンフィラメントに沿って動くミオシンV分子の振舞いを直接高解像撮影することに世界で初めて成功しました(図2)。
従来はタンパク質に蛍光分子を結合させ、蛍光顕微鏡で蛍光輝点の動きを追跡することでタンパク質分子の振舞いを推測していました。それ故、タンパク質分子そのものの動的振舞いを直接観察する技術の開発が望まれていました。
本研究グループは、分子の可視化に使われている従来の原子間力顕微鏡(AFM)を改良し、可視化速度を約1,000倍上げ、働いているタンパク質をそのまま高速撮影できる高速AFMを開発しました。それを用いて、アクチンフィラメントに沿って一方向に動くミオシンV分子の振舞いを高い空間時間分解能で直接観察することに成功しました。その成功により、ミオシンVの運動メカニズムの詳細が解明されました。
高速AFMは、様々な生体分子の機能する仕組みを従来よりも詳しく且つ短時間で明らかにすることができますが、生命科学の基礎研究に限らず、液中で起こる様々なナノメータスケールの現象の解明に役立つことが期待されます。
本研究成果は、2010年10月10日18時(英国時間)に英国科学雑誌「Nature」のオンライン速報版で公開されました。
<研究の背景と経緯>
タンパク質の構造はX線結晶構造解析、電子顕微鏡、NMR、原子間力顕微鏡(AFM)によってこれまで調べられてきましたが、得られる構造情報は実質的に静止構造でした。一方、タンパク質分子の動的振舞いは主に蛍光顕微鏡で観察されてきましたが、蛍光顕微鏡による観察ではタンパク質分子そのものは現れません。従って、タンパク質の構造とダイナミクスを同時に観察することはできません。この技術的限界は、タンパク質が働く仕組みの包括的な理解を妨げてきました。それ故、分子の形とその動きを同時に見ることのできる技術が待望されていました。
<研究の内容>
AFMは柔らかいレバー(カンチレバー)先端に付いた針を試料の1点1点に接触させて、分子全体の形を直接見る顕微鏡で、液中に在る分子でも見ることができます(図3)。ですが、1点1点の接触を分子全体に亘って行うには相当の時間がかかるため、分子の動きは見えませんでした。また、針の接触が分子を壊したり、分子の働きを阻害してしまうという問題を抱えていました。本研究グループは、1点1点の接触動作や接触の検出を高速化するために、微小カンチレバー、試料台を3次元に動かす高速スキャナー、スキャナーの振動を抑制する技術、レバーの動きを高速且つ高感度に検出するセンサーなどを開発するとともに、針を試料に優しく接触させる制御技術など、多くの技術開発を進めてきました。その結果最近になり、理論限界にほぼ近い世界最高性能の高速AFMを開発することに成功しました(図1)。
今回、この新しい顕微鏡を最もダイナミックなタンパク質であるモータタンパク質ミオシンVに適用しました。ミオシンVは等価な2本の脚状構造をもち、細胞内では物質輸送を行っています。それぞれの脚はモータドメインと長いネックから成っています(図2c)。モータドメインにはアクチンに結合する部位とATPをADPとPi(無機リン酸)に加水分解する部位があります。これまで蛍光観察手法などによりミオシンVは集中的に研究され、アクチンフィラメントに沿って約36nmのステップで、ハンドオーバーハンド様式(人が歩くように2本の脚が交互に前進する様式)で連続的に運動することが既に知られていますが、この歩行中の分子の振舞いや前進運動を駆動する張力発生のメカニズムの詳細はよく分かっていませんでした。
ATP存在下でのこの歩行運動を2-3 nmの空間分解能、140msの時間分解能の映像として捉えることに成功しました(図2;全ての映像データは論文のSupplementary MoviesとしてNatureのホームページで見ることができます。 また、http://www.s.kanazawa-u.ac.jp/phys/biophys/M5 _movies_j.htmでも見ることができます)。アクチンに2本の脚で結合して静止状態にいる場合には、両脚は「ハの字」のように開いています(図2a, c)。ここでは、「ハの字」に開いた両脚のうち前進方向にある前脚の向きを「前向き」、前進方向とは反対側にある後ろ脚の向きを「後ろ向き」と呼ぶことにします。歩いているミオシンVの分子映像により、既知の事実(歩幅やハンドオーバーハンド運動)に直接的な視覚的証拠が与えられただけでなく、前進運動や力発生が実際にどのように起こっているかが明瞭に解明されました:(1)前進駆動は前脚の前方への屈曲ではなく、「前向き」から「後ろ向き」への回転で起こること(図2b, d)、(2)2本脚でアクチンに結合すると、前脚は「前向き」で強制的にアクチン結合させられる結果、前脚には回転のための張力が発生すること、(3)後ろ脚がアクチンに結合しているとこの張力による前脚の回転は抑えられていますが、後ろ脚がアクチンから解離することでこの抑制が外れて、前脚は蓄えられていた張力を使って自動的に回転すること、(4)この前脚の回転により、2つのネックが繋がった部分が前方に回転する結果、アクチンから離れた後ろ脚は前方に引っ張られること(図2b, d)、(5)これまで提唱されてきたいくつかのモデルでは後ろ脚はアクチンに接触しながら前方へ移動する(すなわち、後ろ脚が移動の力を出している)と想定されていましたが、実際にはアクチンから大きく離れていること(図2b, d)、(6)この前方への移動後、後ろ脚は前脚を越して前方のアクチンに結合し1歩の前進が完了すること。こうして、1歩前進する間に起こる分子の振舞いのすべてが分子映像に現れ、特に前方への駆動力は前脚が「前向き」でアクチンに結合することによって生じ、後ろ脚のアクチンからの解離で、前脚は自動的に前方へ回転することが分かりました。
ところで、前方への移動は前脚が前方への力を出しているからで、後ろ脚が蹴ることによるのでないことがはっきりしましたが、どうして歩くように等価な2本の脚を交互に移動させることができるのでしょうか。この疑問に対する答えも明確にすることができました。ATPやADP(ヌクレオチド)が前脚に結合している場合には、前脚はほぼ真っ直ぐな形をとるのに対して(図2a, e)、ヌクレオチドが結合していない場合には前脚は鋭く前方に屈曲することが分かりました(図2f)。すなわち、前脚の形を見ると前脚にヌクレオチドが結合しているかどうかが分かります。歩いている分子では前脚はほぼ真っ直ぐなので、前脚にはヌクレオチドがおそらく結合したままであることが推測できます。そこで、色々な濃度のADP存在下で前脚が真っ直ぐな形をとっている寿命を測定したところ、平均で10秒間に1回だけADPが前脚から解離することが分かりました。10秒間にミオシンVは何歩も歩くので、推測通り、歩いている間ADPは前脚から解離していないことになります(言い方を換えれば、ADPが解離する前に前脚は新しい後ろ脚になってしまう)。従って、ADPの解離、それに続く新しいATPの結合、その結果起こるアクチンからの解離は後ろ脚でしか起こらないということがはっきりしました(ADP解離の非対称性)。前脚はADPを結合したままなのでアクチンから解離しないのに対して、後ろ脚は新しいATPを結合してアクチンから解離します。解離すると、前脚が出す張力により前方に引っ張られて前方に移動し、前方のアクチンに結合して後ろ脚は新しい前脚になり、前脚は新しい後ろ脚になります(すなわち一歩前進)。こうして、ミオシンVが歩いて前方に移動する仕組みが直接的、且つ、視覚的に証明されました。
ところで、ヌクレオチドが結合していない場合、前脚は屈曲しますが、前脚からはADPは解離しないので、この屈曲は前進運動とは無関係だということも分かります。更には、これまで全く認識されていなかったFoot Stompという振舞いを発見しました。説明は省きますが、Foot Stompの発見により、ADP-PiからPiが解離して初めて張力が生ずるという従来の説は成り立たなくなり、Piの解離を経なくても、ADPを結合した前脚がアクチンに直接結合することでも分子内に張力が発生し、その張力で前進運動が実際に起こることが証明されました。
<今後の展開>
ミオシンVの動的振舞いを高い空間時間分解能で観察できたことは世界初の成果ですが、ダイナミックな分子プロセスの映像中に多くの事実を同時に見出すことができ、また、視覚的情報は直接的で分かりやすいため、高速AFMはミオシンVに限らず様々な生体分子の機能解明にも極めて有効です。従って、今後この新しい研究手法は多様な生体分子の働く仕組みの解明を加速するでしょう。また、装置の改良により細胞表面や細胞内で起こる動的プロセスの高解像観察も可能になるものと予想されます。更には、生体分子に限らず、洗浄、腐食、電気化学反応、触媒反応など液中の固液界面で起こる様々なナノスケールの動的プロセスの解明にも高速AFMは役立ち、ナノテクノロジーの発展にも大きく貢献するものと期待されます。
<参考図>

図1 開発した高速AFM装置の外観
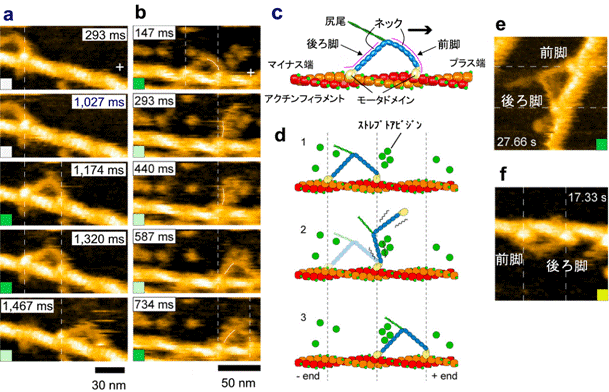
図2 アクチンフィラメントに沿って歩行運動するミオシンVを捉えた高速AFM像(a, b)と前脚の形態の違いを示すAFM像(e, f)。過剰なストレプトアビジン分子を基板に撒かない場合(a)と撒いた場合(b)。撒かない場合には前進運動は速すぎてその途中が見えていないが、前脚と後ろ脚は交換している(bでは交換がはっきり見える)。(c)は2本脚でアクチンフィラメントに「ハの字」で結合したミオシンVの模式図。(d)は(b)の模式図。回転する前脚がストレプトアビジンに一時的に接触して前進運動が遅くなる結果、前進運動中の振舞いが高速AFMで捉えられた。(e)濃いADP存在下でのAFM像。(f)ヌクレオチド非存在下のAFM像。縦もしくは横の破線はモータドメインの重心位置を示す。

図3 カンチレバー探針で試料表面の1点1点に触りながら試料の全体像を撮るAFMの原理とミオシンVの歩行過程(左下)を示す模式図。
<論文>
Noriyuki Kodera, Daisuke Yamamoto, Ryoki Ishikawa, and Toshio Ando Video imaging of walking myosin V by high-speed atomic force microscopy, Nature (published online)
