|

目次
相同組換え,修復,DNA 複製の分子機構(担当:岩崎)
1. 序
相同組換えの機構は,ゲノムに多様性を与えるだけでなく,DNA 修復やゲノムの安定維持に重要な働きをしています。さらに,DNAの損傷などでDNA複製が停止した際、複製を再び開始させる反応にも,積極的に働いています。我々は、生物モデルとして分裂酵母を用いてこのような様々な相同組換えの機能や制御の分子メカニズムを明らかにしようとしています。

2. 相同組換えの反応過程
相同組換えの素反応は、バクテリアからヒトまで保存されたDNAの再編成反応で、一般的には、DNAの2重鎖が切断されることで始まります。次に、そのDNA2重鎖末端の片方がヌクレアーゼによって消化され、生じた1本鎖DNAを利用して、相同な2重鎖DNAを探します。この検索反応は、バクテリアではRecA、真核生物ではそのホモログのRad51タンパク質が中心的な役割を果たしています。RecA/Rad51タンパク質は、生じた1本鎖DNA上にフィラメントを形成し、このDNA-タンパク質高次複合体が、相同DNAの検索反応とDNA鎖交換反応を行います。
真核生物ではRad51のフィラメント形成は厳密に制御されていて、さまざまな補助因子(mediator)が必要なことが分かっています。例えば、リング構造を形成するRad52タンパク質(分裂酵母ではRad22タンパク質と呼ばれています)、Rad55/Rad57複合体、最近我々が新しく同定したSfr1/Swi5複合体などが、Rad51フィラメント形成を助ける補助因子として働きます。我々は、これら補助因子がどのようにRad51のフィラメント形成に関与するか、また、その生物学的機能について、遺伝的な解析と生化学的な手法を駆使して、分子レベルで解明することを目指しています。
RecA/Rad51フィラメントのDNA鎖交換反応によって、1本鎖DNAが相同な二重鎖DNAに入り込んだ構造(D-ループ構造)が形成されます。さらに反応が進むと、二重鎖DNA間どうして、相補鎖を交換した構造ができます。この構造は、提唱者の名前からホリデイ(Holliday構造)と呼ばれています。このホリデイ構造が解離して、組換え型DNAが生じます。我々のグループは、バクテリアRuvCタンパク質が、ホリデイ構造の交差点を切断するエンドヌクレアーゼであることを発見して(Iwasaki et al., EMBO J.1991.10: 4281-4389)その立体構造を明らかにしています(Ariyoshi et al., Cell 1994,78:1063-1072)(下図)。
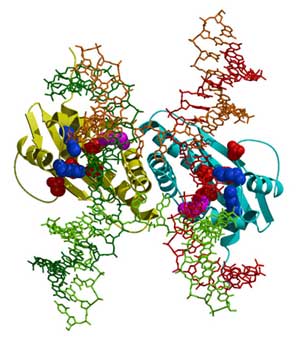
RuvC-ホリデイ構造複合体のモデル(JBC 2001 vol.276 No13の表紙より)
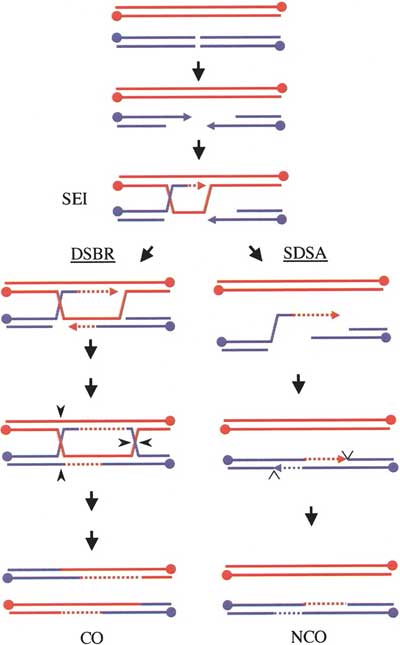
DNAが切断されるとその末端は2つできる訳ですから、2個所での鎖交換反応の結果、二つのホリデイ構造が形成されうるはずです。この反応モデルは、DNA二重鎖切断修復モデル(DSBR モデル:DNA double strand repair model)と呼ばれています(下図)。一方、D-ループからDNA合成が起こり、ホリデイ構造を経ないで、合成された鎖が、元の鎖と再びアニーリングするという反応は、合成依存的単鎖対合モデル(SDSAモデル:synthesis dependent single-strand annealing model)と呼ばれています。減数分裂期組換えは、DSBR モデルに従うような反応とSDSAモデルに従うような反応がほぼ50:50で起こり、体細胞分裂期のDNA二重鎖切断に伴う組換え修復では、ほとんどSDSAモデルに従うような反応が起こると考えられています。

3. 我々のグループの研究内容
最初にも述べたように、我々は、分裂酵母を主なモデル生物として研究しています。方法論は、分子遺伝学、生化学、構造生物学など、対象とする分子の解析進度に応じて様々です。今、注目して解析しているテーマは以下の通りです。
| 1) |
Rad51タンパク質のmediatorの機能解析
我々は、Rad55/Rad57複合体、Swi5/Sfr1複合体を発見し、これらがRad51タンパク質のmediatorとして機能することを示してきました(Tsutsui et al. Genetics 2000.154:1451-1461; Tsutsui et al. Genetics 2001.159:91-105)。さらに、接合型変換という特別な組換え現象においては、Swi5がパートナーをかえSwi2と複合体を形成して、Rad51 mediatorとして機能することを提唱しています(Akamatsu et al. PNAS 2003.100:15770-15775)。これらの事柄について、さらに詳細な解析を進めています。 |
| 2) |
翻訳後修飾による組換え機能の制御機構
ユビキチンやSUMOによって、多数の組換え関連タンパク質が細胞周期やDNA損傷などのストレス応答に応じて、翻訳後修飾されることが明らかになりつつあります。この生理的意義について、解析しています。 |
| 3) |
組換え開始の分子機構
組換え初期過程では、DNA二重鎖切断末端がヌクレアーゼによって消化され、3'が突出するような一本鎖DNAが形成されることが重要なステップです。この反応に重要な働きをしているのがMre11-Rad50-Nbs1複合体です。ヒトのNbs1は、ナイミーへン症候群という高発癌性遺伝病の原因遺伝子ですので、医学的にも大変重要なのですが、我々は、分裂酵母のNbs1ホモログを発見しました(Ueno et al. MCB 2003.23:6553-6563)。現在、このタンパク質の機能解析を行っているところです。また、Mre11-Rad50-Nbs1複合体と伴に機能すると予想される新しい遺伝子を発見しており(正式な名前はまだついていない)、これも同時に解析しています。 |
| 4) |
組換え中間体のプロセッシングのメカニズム
我々は、大腸菌からRuvCというホリデイ構造解消エンドヌクレアーゼ(リゾルベースと呼ばれています)を発見しました。当然、真核生物にもホリデイ構造リゾルベースが存在すると考えられます。そこで、数年前から真核生物のホリデイ構造リゾルベース発見のプロジェクトに取り組んでいます。しかしながら、未だに、世界中のどの研究室からも決定的分子は発見されていません。
SDSA型の反応で組換え体が生じるならば、必ずしも、RuvCタイプのエンドヌクレアーゼは必要ではありませんから、組換え反応そのものの現象を詳細に解析する必要があります。さらに、まだまだ未同定の組換え因子が存在すると予想されます。そこで、我々は、新しい因子を同定してきました。それらのうちで、もっとも注目しているのは、FBh1ヘリケースとSMC6/6複合体です。これまでの遺伝学的解析で、確かに、これらの分子は、組換え反応の中期以降に働いていることが示唆されています(Morishita et al. MCB 2002.22:3557-3548; Morikawa et al. MCB 2004. 24:9401-9413; Morishita et al MCB 2005 印刷中) 。今後は、実際にその確固たる証拠を掴むべく、メンバー全員で努力しているところです。 |

4. 共同研究
我々は、他大学・他研究期間の多くの方々と共同研究をして、研究を推進しています。
主な共同研究先(敬称は省略させていただきます)
大阪大学 品川日出夫、菱田卓、森下卓
遺伝学研究所 山尾文明、筒井康博
九州大学 石野良純
生物分子工学研究所 森川耿右、真柳浩太
フランス・パスツール研 B. Arcangioli
イギリス・MRC A. Carr
等
皆さんも、我々のグループに参加して、いろんな大学や研究所に行き来して、活発に研究をやってみませんか?

閑話休題:(高校生や生物系以外の大学生、及び一般社会人の方へ)
1.変化するゲノムと変化しないゲノム
遺伝情報を担うDNAは、細胞中で、安定に維持されます。分裂していてもしなくても、一般的には、細胞はゲノムが変化することを好みません。しかし、DNAの変化を積極的に促進している細胞(または、シチュエーション)も存在しています。その最も身近な存在は、免疫グロブリン産生細胞ではないでしょうか?外敵が体内に進入した際、それをやっつける免疫グロブリンを産生遺伝子は、外敵(抗原)に応じて、適宜変化するのはよく知られた事実です。また、知ってはいるのだけど、あまり実感が湧かないという事例は、生殖細胞(卵子と精子)の形成過程、すなわち、減数分裂ではないでしょうか。実は、生じた無数の生殖細胞の一個一個の細胞に含まれるゲノムDNA配列はどの細胞一つとして同じものが無いぐらい劇的に変化しています。これら以外にも、病原性バクテリアの表面抗原の変化や、酵母の接合型変換、トランスポゾンによる転移なども、ゲノム変化(再編成)の例といえるでしょう。
ところで、最初に「一般的には、ゲノム情報は安定に維持される」と書きました。種を保存し、個体の生存を保障し、細胞分裂によって正確なコピーをつくるためには、必須の過程です。これが、まさしく「遺伝」の本質といっても過言でないでしょう。この過程は正確なゲノム複製によって保障されています。ゲノムDNAを正確にコピーするため、DNAポリメラーゼを含む複製酵素複合体マシーナリーが、驚くべく精緻なメカニズムで正確さを確立しています。
しかし、生体内のDNAは常に損傷の危機に曝されています。DNA損傷剤の卑近な例として、多くの発ガン性物質が挙げられるのですが、太陽光に含まれる紫外線やレントゲンに使われるX線なども、DNAに傷を入れることが知られています。さらに重要なことは、我々は酸素呼吸をしますが、その酸素呼吸によって生じる活性酸素がDNAに傷を入れてしまいます。すなわち、生きることそのものがDNAに傷を入れることにほかならないのです。
DNAに傷が入ったままだと、いろんな不都合がおきます。例えば、タンパク質をコードしている遺伝子の上に傷があると、転写がストップしてしまい、タンパク質合成に支障をきたします。また、DNA複製の際には、突然変異が誘発されます。また、あまりに傷が重篤だと、細胞機能そのものを失い、細胞死に至ります。しかし、細胞(生物)は、この有害なDNAの傷を元通りに直す様々な仕組みをもっています。
ところで、DNAの傷を「元通り」に直すには、「元」の遺伝情報を知る必要があります。その鍵は、二重鎖DNAがつくっているA:TとG:Cのペアです。すなわち、片方のDNA鎖に傷がある場合には、もう片方の鎖(相補鎖)の情報を利用すれば、「元通り」に直すことができます。ですから、個々の詳しいメカニズムには触れませんが、相補鎖さえ無傷であれば、原理的には完全な修復が可能となる訳です。
ところが、DNAの二重鎖が同時に切断されるような傷の場合はどうでしょう?切断されたところには、もともと1塩基対の欠失もなかったのか、もしくは、多数の塩基対の喪失が起こってしまったのか、それだけでは判断がつきません。その場合、細胞はどうやってそれを判断し、正確に「元通り」に直すのでしょう?それは、相同染色体の遺伝情報を利用することによって達成されます。*注 相同染色体:対をなし、それぞれが雄親と雌親に由来する染色体で、基本的な遺伝情報は重複して存在している。
それでは、どのように相同染色体の遺伝情報を利用して修復するのでしょうか?それは、先に述べた減数分裂期に起こるゲノムの再編成のメカニズムと同様な機構で修復される事が分かっています。減数分裂期のDNA再編成、すなわち、「相同組換え」は、プログラムされたDNAの二重鎖切断によって開始されますが、体細胞分裂時に、X線被爆などのアクシデントによって生じたDNAの二重鎖切断も相同組換え機構を利用した修復系で直されるのです。ですから、「相同組換え」は、ゲノムの変化と恒常性維持の両方に積極的に関与しているのです。
続く
次回の更新のときに、続きは掲載します。

|