1.体験!ドラッグ・ディスカバリーと核磁気共鳴分光法(NMR)の力(6月1日)
2019.06.01
〜 2019.06.01
- 入試
- 講座・セミナー
体験!ドラッグ・ディスカバリーと核磁気共鳴分光法(NMR)の力

はじめに
NMRは、超電導磁石による強い磁場中に置かれた原子核が電磁波と相互作用することを利用した分光法です。NMRにより私たちは、タンパク質や核酸など生体高分子について、立体構造や、分子運動、分子間相互作用といった非常に有益な情報を得ることが出来ます。横浜市立大学・鶴見キャンパスにはNMR装置が合計6台(表1、図1)あり、私たちはこれらの装置を用いて、生命現象、病気、創薬などの問題を、分子・原子レベルの分解能で解明しようと取り組んでいます。

この体験!では、試料の調製法からタンパク質(酵素やレセプター)と薬剤候補となる標的化合物(基質や低分子リガンド)のスクリーニング方法、及びターゲットタンパク質との結合部位の同定方法について紹介するとともに、参加者には、これらの装置を実際に操作していただきます。
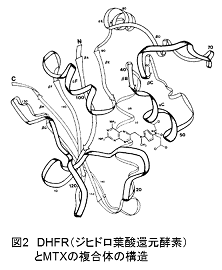
目的:抗癌剤や抗生物質などの標的として注目されてきたDHFR(ジヒドロ葉酸還元酵素)と、基質を含む低分子化合物を用いて、NMRによる相互作用解析を体験する。
背景:DHFRは、核酸やアミノ酸を合成する際に補酵素として働くテトラヒドロ葉酸を作る重要な酵素です。テトラヒドロ葉酸は、緑黄野菜やレバー(肝臓)などの食べ物から摂取されるビタミンの一つ、葉酸を代謝する経路で作られます。この経路において、DHFRはジヒドロ葉酸を還元し、テトラヒドロ葉酸に変換する直接的な働きを持っています。1940年代に葉酸と構造が類似したメトトレキサート(MTX)が開発されました。MTXはDHFRの活性を阻害し、葉酸の代謝経路をトラップすることで核酸やアミノ酸の合成を止めるなど、幅広い抗腫瘍効果を示します(図2)。体験!では、これらDHFRとMTXの相互作用を解析します。
背景:DHFRは、核酸やアミノ酸を合成する際に補酵素として働くテトラヒドロ葉酸を作る重要な酵素です。テトラヒドロ葉酸は、緑黄野菜やレバー(肝臓)などの食べ物から摂取されるビタミンの一つ、葉酸を代謝する経路で作られます。この経路において、DHFRはジヒドロ葉酸を還元し、テトラヒドロ葉酸に変換する直接的な働きを持っています。1940年代に葉酸と構造が類似したメトトレキサート(MTX)が開発されました。MTXはDHFRの活性を阻害し、葉酸の代謝経路をトラップすることで核酸やアミノ酸の合成を止めるなど、幅広い抗腫瘍効果を示します(図2)。体験!では、これらDHFRとMTXの相互作用を解析します。
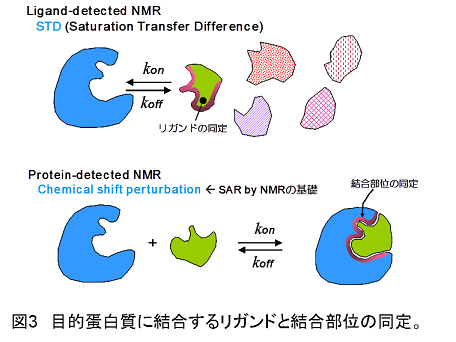
原理:「NMRスクリーニング法」として2つの方法を行います(図3)。
(1)Saturation Transfer Difference(飽和移動差スペクトル法):タンパク質に対するリガンドを低分子化合物のプールから探し出すのに有用です。結合部位の同定にも利用されます。
(2)Chemical Shift Perturbation:タンパク質中のリガンド結合部位を同定するために使われる方法です。
(1)Saturation Transfer Difference(飽和移動差スペクトル法):タンパク質に対するリガンドを低分子化合物のプールから探し出すのに有用です。結合部位の同定にも利用されます。
(2)Chemical Shift Perturbation:タンパク質中のリガンド結合部位を同定するために使われる方法です。
実験: 実際にNMR装置を操作し、以下の実験・解析を体験していただきます!
(1)NMRにより、DHFR、及びMTXを含む低分子化合物のスペクトルを測定する。
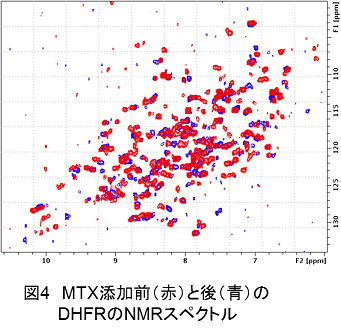
(2)DHFRの単独状態、及び低分子化合物との結合状態でのスペクトルを比較し(図4)、DHFRの低分子化合物結合部位を同定する。
(1)NMRにより、DHFR、及びMTXを含む低分子化合物のスペクトルを測定する。
(2)DHFRの単独状態、及び低分子化合物との結合状態でのスペクトルを比較し(図4)、DHFRの低分子化合物結合部位を同定する。