海洋微生物の塩化物イオンポンプロドプシンの輸送機構の解明
新しい再生医療や新薬開発の基礎的研究への貢献に期待
横浜市立大学生命医科学研究科の構造創薬科学研究室(朴三用教授研究グループ)の石本直偉士(博士前期課程1年生)、大木規央(JSPS海外特別研究員; 英国Research Complex at Harwell, UK;市大卒業生)と国際共同研究グループらにより、海洋微生物の塩化物イオンポンプロドプシンの輸送機構の仕組みを世界で初めて解明することに成功しました。この知見は、光を使って細胞機能を操作する光遺伝学*1 (optogenetics)のツール開発につながるため、今後、新しい再生医療や新薬開発の基礎的研究への貢献が期待されます。本研究成果は、アメリカ科学振興協会(AAAS)が発行するScience Advancesにオンライン掲載(日本時間 令和2年2月8日午前4時付)されました。
研究の背景
地球全体のバイオマス生産の大半を占める海洋生態系の微生物は、地球の物質循環とエネルギーのバランス維持に重要な役割を果たしています。海洋環境に生息する大多数の微生物が保有する光活性タンパク質であるロドプシン(microbial rhodopsin)の発見とその機能に関する研究は、植物のクロロフィルを用いた光合成反応が太陽エネルギーを生体エネルギーに捕獲する唯一の手段とされていた既存の概念に大きな変化をもたらしました。ロドプシンは光活性イオンチャンネル又はセンサーとして、光を受けると分子内のレチナール(chromophore; 発色団)の構造変化を誘導し、イオンを膜内外に輸送する膜タンパク質です。海洋微生物(細菌)に存在するロドプシンの構造と機能の応用については、2000年に最初に発見された水素イオンポンプのプロテオロドプシンを対象とする研究が盛んに行われています。プロテオプロドプシンは、膜内外に水素イオン濃度勾配差を発生させて、ATPポリメラーゼに生体エネルギー生成を誘導することが知られています。一方、細菌由来塩化物イオンポンプロドプシンは2014年にNonlabens marinus S1-08菌株で最初に報告され、塩化物イオンを細胞膜の外側から内側に輸送することが明らかになっていますが、その輸送機構や、その後のエネルギー生成機構の解明には至っていませんでした。
研究の内容と成果
本共同研究グループは、大腸菌を利用してNonlabens marinus S1-08菌株から塩化物イオンポンプロドプシン(NM-R3)の生産・精製を行い、LCP *2(Lipidic Cubic Phase)法を用いてNM-R3結晶を得ました。その後、NM-R3結晶を低温(95K又は140K)の状態で緑色レーザー光(波長532nm)により分子を励起させ、反応機構の初期中間体の構造をトラップして、世界で初めて原子レベルで動画に収めることに成功しました。
・レーザー光照射によるNM-R3タンパク質結晶の吸収スペクトル変化
緑色レーザー光の強度(連続レーザーとパルスレーザー)や温度を変え、結晶内に照射し顕微分光法で測定すると、活性中心であるレチナール分子周辺の構造変化に伴うスペクトルが長波長へ移動(レッドシフト)していることが観察されました。このピークシフトは主にレチナールのシッフ塩基の構造変化に由来すると見られる一方、ロドプシンが光を受けた時に誘導されるレチナールの構造変化、すなわちレチナールの光異性化反応であるcis型レチナール(all-trans型レチナールのC13=C14の二重結合の異性化 *3)への変化は見られませんでした(図1.)。このことは、NM-R3が、これまでに知られている海洋微生物由来ロドプシンとは異なる反応機構を備えていることを示唆しています。
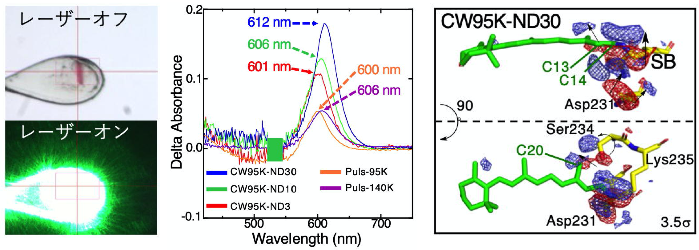
図1. ロドプシン(NM-R3)結晶へのレーザー光照射とNM-R3の構造変化
(左)上:結晶への照射前の明視野画像 下:照射時の蛍光観察画像
(中)532nm緑色レーザー光(連続レーザー:CWとパルスレーザー:Puls )照射によるNM-R3結晶の吸収スペクトルの変化
(右)レチナール近傍のレーザー光照射前/照射時の差フーリエマップの例
電子密度分布の変化(赤、青の領域)がみられ、レーザー光照射によるレチナール(緑)周辺の構造変化が起こっている(右)。
・塩化物イオンポンプの輸送機構
ロドプシンは様々な機能(H+, Na2+, Cl-等のイオンポンプ)を持つ膜タンパク質の中で最も研究が進んでいる分子ですが、イオンポンプの輸送機構は今日まで解明されていませんでした。しかし本共同研究グループは、上記の方法で、分子内に5個の塩化物イオンが細胞外から細胞質へ移動する経路を見つけることができました(図2.)。また、レーザー光の照射前と照射時の差フーリエマップから、特定された5個の塩化物イオンの経路に関わっているアミノ酸F90W, Q224W, S60F, C105F, C105Aの変異体を作製し、酵素活性を測定すると、変異体では酵素活性の著しい変化が見られ、塩化物イオンの輸送経路を特定することができました。そして、細胞外から、アミノ酸F90を経由し、レチナール分子周辺を通り細胞内へと導く、塩化物イオンの輸送経路を世界で初めて原子レベルで動画に収めることに成功しました。
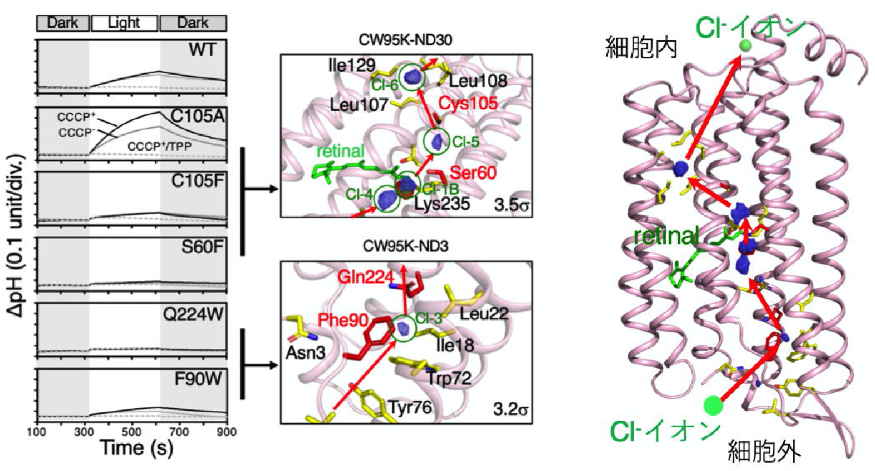
図2. ロドプシン分子内での塩化物イオン(Cl-)の移動
(左)ロドプシン分子のアミノ酸(Cys105, Ser60, Gln224, Phe90)変異体の酵素活性(塩化物イオンの輸送活性)の変化。野生型(WT)に対して変異体の酵素活性が変化しており、これらのアミノ酸が塩化物イオンの輸送経路に関わっていると考えられる。
(中)ロドプシン分子内のレーザー光の照射前/照射時の差フーリエマップ。電子密度分布の変化により塩化物イオンがCys105, Ser60, Gln224, Phe90近傍のCl-3, Cl-4, Cl-1B, Cl-5, Cl-6を移動していることがわかる。
(右)塩化物イオンの細胞内部への輸送経路(赤矢印)
(中)ロドプシン分子内のレーザー光の照射前/照射時の差フーリエマップ。電子密度分布の変化により塩化物イオンがCys105, Ser60, Gln224, Phe90近傍のCl-3, Cl-4, Cl-1B, Cl-5, Cl-6を移動していることがわかる。
(右)塩化物イオンの細胞内部への輸送経路(赤矢印)
今後の展開
今回、結晶に対して低温条件で波長や強度の異なるレーザーを照射し、その励起状態を解析する方法で、X線結晶構造解析等の静的な構造解明の概念を超えた反応動的な構造解析による分子動画を撮ることができ、塩化物イオンポンプロドプシンの輸送機構の解明に成功しました。今後も、このような手法により、光活性タンパク質の動く様子を原子レベルで捉えることで、将来の創薬分野や光遺伝学ツールの開発への応用も期待されます。
用語解説
*1 光遺伝学(optogenetics): 光感受性のイオンチャンネル・酵素等を細胞や生体内に発現させて、それらの機能や形態形成等を光でコントロールする技術のこと。微生物型ロドプシン類による神経細胞の活動電位制御。
*2 LCP(Lipidic Cubic Phase)法: 結晶を作る方法のひとつ。水溶液とキュービック相と呼ばれる相になった脂質とを混合すると、水溶液が脂質で囲まれた水チャンネルが形成される。ここに膜タンパク質を混ぜると、キュービック相に再構成され、結晶ができる。
*3 異性化: 化学的、物理的作用により、ある化合物がその異性体に変化すること。
*2 LCP(Lipidic Cubic Phase)法: 結晶を作る方法のひとつ。水溶液とキュービック相と呼ばれる相になった脂質とを混合すると、水溶液が脂質で囲まれた水チャンネルが形成される。ここに膜タンパク質を混ぜると、キュービック相に再構成され、結晶ができる。
*3 異性化: 化学的、物理的作用により、ある化合物がその異性体に変化すること。
※本研究は、文部科学省・新学術領域研究「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用」と、AMED「創薬等ライフサイエンス研究支援基盤事業」の支援を受けて遂行しました。
論文著者、ならびにタイトル
Pumping mechanism of NM-R3, a light-driven bacterial chloride importer in the rhodopsin family.
Ji-Hye Yun†, Mio Ohki†, Jae-Hyun Park, Naito Ishimoto, Ayana Sato-Tomita, Wonbin Lee, Zeyu Jin, Jeremy R.H. Tame, Naoya Shibayama, Sam-Yong Park*, Weontae Lee*
(†These authors contributed equally; *Corresponding author)
Science Advances 2020; 6 : eaay2042 7 February 2020.
掲載論文
記者発表資料
Ji-Hye Yun†, Mio Ohki†, Jae-Hyun Park, Naito Ishimoto, Ayana Sato-Tomita, Wonbin Lee, Zeyu Jin, Jeremy R.H. Tame, Naoya Shibayama, Sam-Yong Park*, Weontae Lee*
(†These authors contributed equally; *Corresponding author)
Science Advances 2020; 6 : eaay2042 7 February 2020.
掲載論文
記者発表資料
問い合わせ先
(研究内容に関するお問い合わせ)
大学院生命医科学研究科 構造創薬科学研究室
教授 朴 三用
TEL:045-508-7229 E-mail:park@yokohama-cu.ac.jp
(プレスリリースに関するお問い合わせ、取材対応窓口、資料請求等)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 E-mail:kenkyupr@yokohama-cu.ac.jp
大学院生命医科学研究科 構造創薬科学研究室
教授 朴 三用
TEL:045-508-7229 E-mail:park@yokohama-cu.ac.jp
(プレスリリースに関するお問い合わせ、取材対応窓口、資料請求等)
研究企画・産学連携推進課長 渡邊 誠
TEL:045-787-2510 E-mail:kenkyupr@yokohama-cu.ac.jp